di Simone Casiraghi
Il congresso EHA di Bucarest, la conferenza delle associazioni europee Huntington, è ormai alle porte. Meno di un mese, ma le novità e gli aggiornamenti che verranno presentati e che coinvolgeranno l’intera comunità coinvolta dalla malattia di Huntington si fanno già sentire. La prima sollecitazione è arrivata in questi giorni.
Astri Arnesen, presidente dell’European Huntington Association (EHA) e Presidente dell’ European Federation for Neurological Associations (EFNA), ha inviato una lettera per promuovere uno degli incontri che l’Associazione terrà a Bucarest (Riunione dei soci EHA, il 25 settembre 2025, all’Hotel Ramada Plaza). Nell’invito Arnesen non ha solo anticipato che si parlerà delle ultime novità legate ai progetti europei, in particolare l’Huntington Academy e Moving Forward (progetti su cui torneremo anche noi di Huntington Onlus con approfondimenti). Ma ha segnalato in particolare uno dei workshop: l’incontro è dedicato al coinvolgimento dei pazienti nella Health Technology Assessment (HTA).
Perchè è importante?
Perché, nonostante questo regolamento sia entrato in vigore l’11 gennaio 2022, la sua applicazione piena e concreta è iniziata solo quest’anno, da inizio 2025. Ed è da qui che si inizierà a informare e a parlare degli aggiornamenti dell’ultimo anno.
Ma di che cosa si tratta, di cosa parla il regolamento Health Technology Assessment (HTA)?
La presidente Arnesen rimanda a un articolo sul sito dell’EHA per un approfondimento. È un testo tecnico, quasi per addetti ai lavori, le cui informazioni però comportano ricadute su tutti, in termini di benefici e di migliori condizioni di vita dei pazienti.
Proviamo però una divulgazione più semplice, alla portata dei meno esperti, rimandando comunque al testo qui (What are Health Technology Assessments and whydo they matter? Understanding the path to access to therapies) per un approfondimento ulteriore.
Garantire più equità ai pazienti è una priorità
Che cos’è, quindi, l’Health Technology Assessment, HTA? E che cosa comporta in termini pratici?
Una prima definizione può partire da qui: si tratta di una prima armonizzazione della valutazione delle tecnologie sanitarie. Significa che la nuova legge europea può garantire più equità ai pazienti nell’accesso alle terapie. Inoltre, conseguenza è anche che la Regolamentazione europea sulle HTA (Regolamento UE 2021/2282) entrata in vigore nel gennaio scorso, ha aperto una fase nuova anche per caregiver e i sistemi sanitari dei Paesi membri dell’Unione Europea.
Questo perché le HTA sono valutazioni rigorose delle tecnologie sanitarie, e ne analizzano l’efficacia clinica, il valore economico e l’impatto sulla società. In pratica rispondono a domande cruciali, come ad esempio: la terapia funziona meglio delle opzioni già esistenti? Vale il suo costo? Può migliorare la qualità di vita dei pazienti? Non solo.
L’articolo spiega molto bene anche come per le malattie rare, come la Malattia di Huntington, le HTA affrontano sfide uniche che possono cambiare radicalmente la vita dei pazienti. Le malattie rare come l’Huntington spesso non hanno visibilità, e le informazioni sono spesso insufficienti per capire gli impatti più ampi sui pazienti e sui caregiver, anche solo in termini di rimborso. Le HTA ora stanno iniziando a prendere sempre più in considerazione i dati del mondo reale ossia informazioni raccolte al di fuori dei trial clinici, proprio per superare questi limiti.
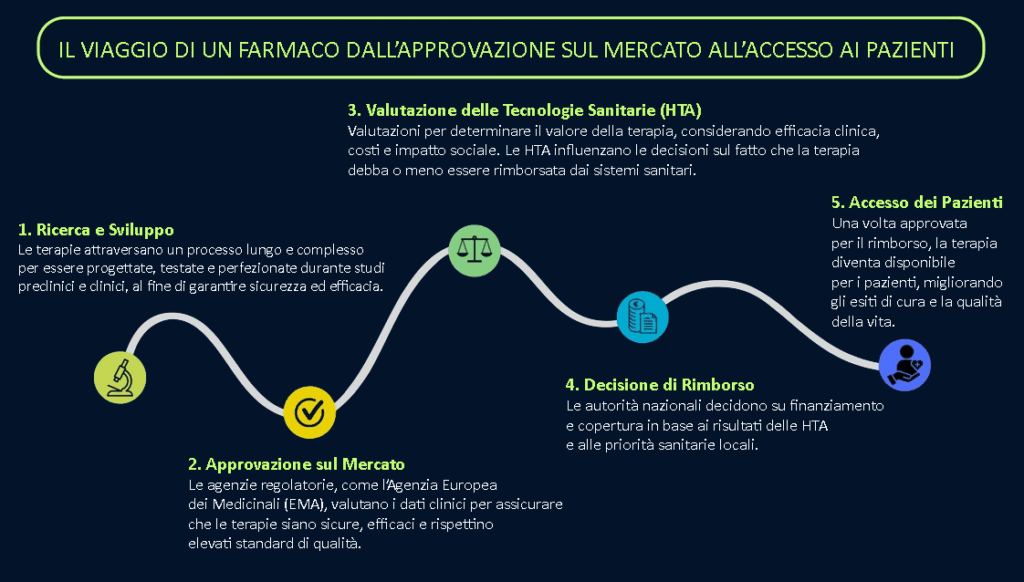
Ecco le novità e le nuove regole
Ma entriamo nel dettaglio della nuova normativa. Fino ad oggi, ogni singolo Paese europeo ha condotto in modo indipendente le proprie valutazioni delle tecnologie sanitarie (HTA) come farmaci, terapie, medicine, tecnologie riabilitative. Questo significava per esempio che, una volta approvato un farmaco dall’Agenzia Europea dei Medicinali (EMA), l’accesso reale a quel farmaco da parte dei pazienti dipendeva da processi nazionali spesso lenti, complessi e soprattutto molto diversi tra loro. Il risultato era spesso deleterio: ritardi, duplicazioni di lavoro, dispersione di risorse e soprattutto disuguaglianze fra i pazienti da un paese all’altro. Alcuni pazienti potevano accedere subito a una nuova terapia, altri invece restavano in attesa per mesi o addirittura anni.
Non solo, quando verrà sviluppato anche un nuovo trattamento, soprattutto per malattie rare come la Malattia di Huntington, non sarà più ogni singolo Stato a partire da zero con le proprie analisi, ma ci sarà un giudizio comune sui benefici clinici del farmaco. Questo dovrebbe ridurre i ritardi e dare ai pazienti più possibilità di ricevere le cure innovative nello stesso momento in tutta Europa.
Ecco cosa prevede la nuova normativa
Il Regolamento introduce le cosiddette Valutazioni Cliniche Congiunte (Joint Clinical Assessments – JCAs): una valutazione unica e condivisa del valore clinico di una nuova terapia.
L’obiettivo è duplice: da un lato, ridurre i tempi di attesa eliminando la duplicazione degli studi in ogni Stato. Dall’altro garantire maggiore equità, assicurando che i pazienti di tutta Europa possano partire da basi comuni di valutazione. E quindi di possibilità di cura.
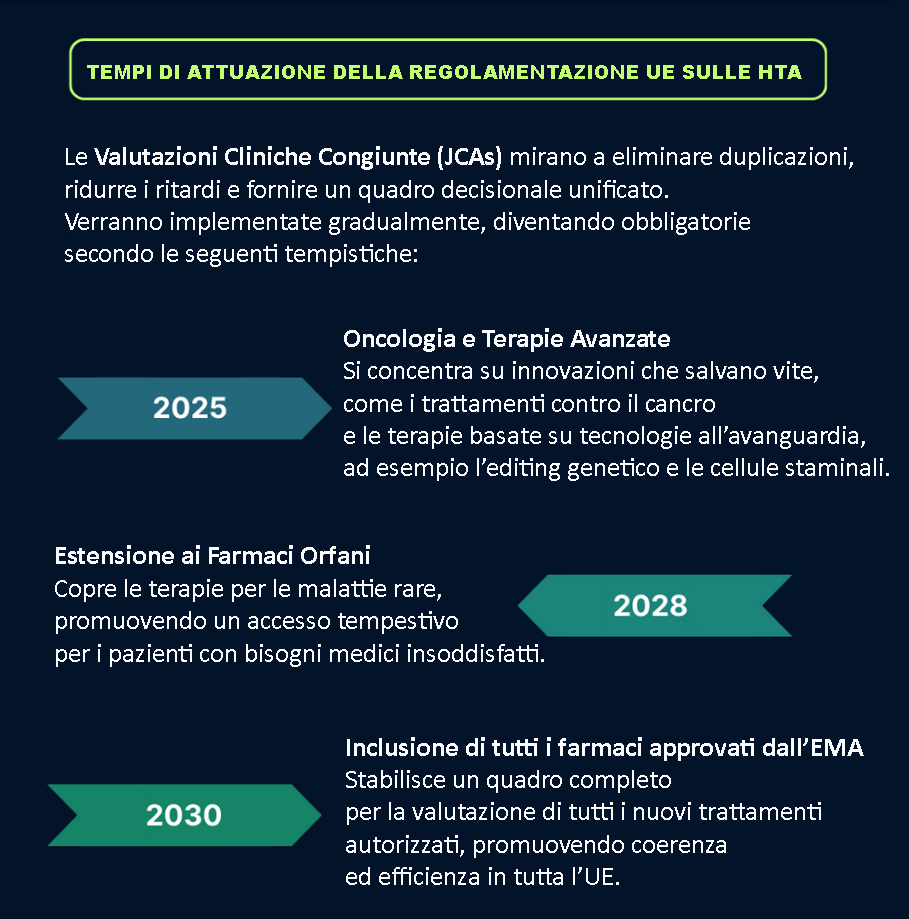
In questo grafico, qui sotto, ecco come le Valutazioni Cliniche Congiunte (JCAs) saranno introdotte gradualmente: da quest’anno 2025 riguarderanno i farmaci oncologici e le terapie avanzate, dal 2028 i farmaci orfani – molto costosi da sviluppare – per le malattie rare come la Malattia di Huntington, le HTA affrontano sfide uniche, come i costi elevati dei trattamenti e la scarsa consapevolezza e dal 2030 tutte le nuove medicine approvate dall’Agenzia Europea del Farmaco.
Che cosa può cambiare e cosa significa per pazienti e caregiver.
Per i malati di patologie rare, la novità viene definita “cruciale”. Per i pazienti e i caregiver questo significa soprattutto una cosa: più equità. Che si viva in Italia, in Spagna o in un piccolo Paese europeo, l’accesso a una nuova terapia potrà essere più veloce e meno legato alle differenze nazionali.
Le terapie innovative, spesso molto costose e complesse, rischiano infatti oggi di essere penalizzate dai modelli tradizionali di valutazione economica, significa “costi troppo alti”. Inoltre, Le malattie rare spesso non hanno visibilità, e ciò significa che gli impatti più ampi sui pazienti e sui caregiver possono essere trascurati nelle valutazioni per il rimborso. Per rispondere a queste sfide, le HTA stanno iniziando a prendere sempre più in considerazione i dati del mondo reale (real world data), ossia informazioni raccolte al di fuori dei trial clinici.
Con il nuovo sistema europeo, invece, si punta a dare più visibilità alle malattie rare, che finora potevano o finivano per essere trascurate nei processi nazionali. Ad aumentare la qualità scientifica delle valutazioni, proprio grazie a gruppi di esperti europei dedicati. E infine a favorire una distribuzione più equa delle cure,indipendentemente dal Paese di residenza.
Un ulteriore aspetto importante è che le Valutazioni Cliniche Congiunte (JCAs) riguarderanno il profilo clinico delle terapie, ma alla fine le decisioni sul rimborso resteranno comunque nazionali. Questo significa che i governi dovranno comunque stabilire se e come finanziare le cure. Tuttavia, avere un’analisi scientifica unica e condivisa potrà rendere le decisioni più rapide e trasparenti.
Quale scenario nuovo per le malattie rare.
Per malattie come l’Huntington, quindi, le valutazioni HTA hanno sempre incontrato ostacoli: pochi dati disponibili, mancanza di esperti e difficoltà nel dimostrare la “convenienza” economica di trattamenti destinati a piccoli numeri di pazienti.
La nuova normativa, ascoltando la valutazione degli esperti e dei medici – mettendo insieme competenze e conoscenze a livello europeo, dovrebbe o quanto meno punta a superare questi limiti. Se funzionerà, e il regolamento verrà interamente applicato con rigore, lo scenario che si apre è quello di un’Europa in cui l’accesso alle terapie “sarà più uniforme, più veloce e meno discriminante”.
Per chi ogni giorno convive con una malattia rara e per chi se ne prende cura, questo significa poter contare su una speranza in più: che i confini nazionali non diventino più un ostacolo alla salute.
Glossario semplice
HTA (Health Technology Assessment)
Valutazione scientifica che analizza l’efficacia di un farmaco o di una tecnologia sanitaria, il suo costo e l’impatto sulla società. In pratica, serve a stabilire se una nuova terapia è utile, funziona davvero e se vale la spesa.
EMA (European Medicines Agency)
L’agenzia europea che decide se un farmaco è sicuro ed efficace, approvandone la commercializzazione nell’UE. È il primo passo per portare un nuovo trattamento ai pazienti.
JCA (Joint Clinical Assessment)
La grande novità della nuova legge europea: una valutazione clinica unica e condivisa tra tutti i Paesi UE. Permette di evitare duplicazioni di lavoro e accelerare l’accesso dei pazienti alle cure.
Farmaco orfano
Un medicinale sviluppato per malattie rare, che colpiscono poche persone. Poiché i pazienti sono pochi, questi farmaci rischiano di essere molto costosi e meno “interessanti” per le aziende farmaceutiche, perciò hanno bisogno di regole speciali per arrivare ai malati.
Terapia avanzata
Trattamenti innovativi che usano tecnologie molto sofisticate, come terapia genica, cellulare o basata su nuovi approcci biologici. Possono offrire grandi speranze, ma richiedono processi complessi di valutazione.
Rimborso
La decisione finale, presa dai governi nazionali, su chi paga il farmaco e se i pazienti possono riceverlo gratuitamente o a un costo ridotto. Anche con la nuova normativa europea, questa scelta resterà nelle mani dei singoli Stati.
Equità di accesso
Il principio secondo cui tutti i pazienti, ovunque vivano nell’UE, dovrebbero avere le stesse opportunità di accedere a nuove terapie, senza ritardi o differenze ingiustificate tra Paesi.
